日前,来自同济大学医学院、加州大学洛杉矶分校和南京医科大学的研究人员,采用单细胞 RNA 测序技术揭示了人类和小鼠早期胚胎的遗传程序,研究成果发表在7月28日的《自然》(Nature)杂志上。
同济大学医学院的薛志刚(Zhigang Xue)博士、南京医科大学的刘嘉茵(Jia-yin Liu)教授及加州大学洛杉矶分校的范国平(Guoping Fan)教授是这篇论文的共同通讯作者。
哺乳动物胚胎发育起始于卵子和精子的融合。经历迁移、基因组和表观遗传时空表达调控以及受精卵/胚胎基因组活化等过程形成桑椹胚,进而形成囊胚,植入子宫壁并进一步发育成胚胎。哺乳动物植入前胚胎发育的程序化过程,是发育生物学的核心问题,弄清这一过程,对于研究哺乳动物早期发育具有重要意义。因受到研究方法、实验材料等因素的影响,过去对于人类植入前胚胎发育的基因表达谱研究受限。近年来单细胞 RNA 测序( RNA -seq)技术进展,为以高分辨率研究早期人类胚胎中的基因调控提供了前所未有的机遇。
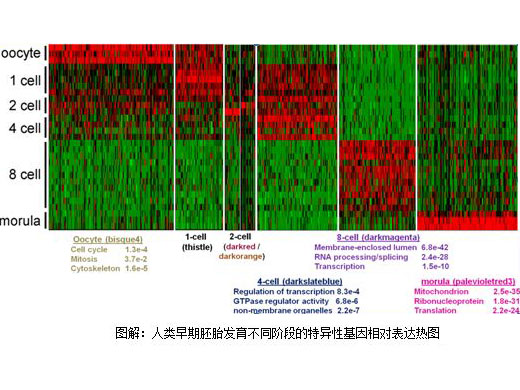
在这项最新研究中,研究人员采用单细胞 RNA 测序对人类和小鼠胚胎从卵母细胞到桑椹胚阶段的转录组动态进行了全面的分析。基于人类卵裂球信使 RNA s单核苷酸变异(single-nucleotide variant,SNV)以及父系特异性单核苷酸多态,研究人员确定了相当重要一部分(25-53%)多态基因转录物(polymorphic gene transcripts)的阶段特异性单等位基因表达模式。
通过权重基因共表达网络分析(WGCNA),研究人员发现通过少量共表达基因功能性模块就可以简明地描绘每个发育阶段。这表明在细胞周期、基因表达、翻译和代谢信号通路发生了按顺序连续的转录变化,从卵裂到桑椹胚阶段以分阶段的方式发挥作用,且该机制在物种间保守存在。跨物种比较小鼠植入前胚胎和人类植入前胚胎揭示,大多数的人类阶段特异性模块(9 个中有 7 个)显著得以保留,人类和小鼠之间发育特异性和时序上存在差异。
此外,研究人员鉴别了人类和小鼠网络中一些保守的模块成员:hub 基因。这些新型的候选基因有可能在驱动哺乳动物植入前胚胎发育中发挥了关键性的作用。
这些研究结果为阐明早期胚胎逐步发育过程中的基因调控机制提供了宝贵的资源,并有可能对干细胞研究领域及改善人类辅助生殖技术产生重要及深远的影响。
以下为同济大学医学院官方新闻稿:
同济大学教授在《自然》杂志发表创新论文

2013年07月29日,国际学术期刊《Nature》在线发表了同济大学附属同济医院转化医学中心、同济大学医学院再生医学系薛志刚博士为第一作者和共同通讯作者的研究论文“Genetic Programs in Human and Mouse Early Embryos Revealed by Single-Cell RNA -Sequencing "。在这项与南京医科大学第一附属医院临床生殖中心刘嘉茵教授课题组和加州大学洛杉矶分校人类遗传系的范国平教授(同济大学讲座教授)课题组合作完成的研究中,薛博士等利用单细胞 RNA 测序( RNA -seq)技术,在国际上首次对人及其他哺乳动物胚胎着床前发育的转录调控网络进行了系统分析,充分地阐明了胚胎早期发育过程中的相关重要科学问题。
哺乳动物胚胎发育起始于卵子和精子的融合。经历迁移、基因组和表观遗传时空表达调控以及受精卵/胚胎基因组活化等过程形成桑椹胚,进而形成囊胚,植入子宫壁并进一步发育成胚胎。长期以来,对早期胚胎的转录组研究受到样本细胞太少而无法定量分析的制约,从而对哺乳动物特别是人类的早期胚胎发育基因调控知之甚少。本研究利用单细胞表达谱研究的 RNA -seq技术,突破了起始样本量少的瓶颈,对人胚胎早期发育各阶段全基因组 RNA 转录谱的系统分析,发现在胚胎发育早期各阶段中存在着父亲或母亲来源的单等位基因表达差异。同时运用加权基因共表达网络分析(WGCNA)显示胚胎早期发育各阶段中的细胞周期、基因调控、蛋白质翻译以及代谢通路的转录变化是以分步进行的方式按顺序发生,并明确了该机制在物种间保守存在,仅在发育特异性和时序上有所差异,证明了哺乳动物早期胚胎发育进化上的共性。此外,该研究还发现了驱动胚胎早期发育各阶段的关键候选基因。
该项研究成果将在干细胞的纯化、分类及临床治疗领域产生深远的影响,文章系统的分析了哺乳动物早期胚胎全能细胞的分化过程,并得到了各细胞阶段的分子标记,这为全能细胞的挑选和临床干细胞治疗提供指导依据,特别是在一些难治性疾病,如神经细胞的损伤与治疗提供帮助。同时该研究成果也将为人类辅助生殖技术,俗称“试管婴儿”技术带来福音。虽然人类辅助生殖技术已经取得了长足的进步,但其临床应用依然面临如何提高成功率、对早期胚胎进行医学遗传学检测、降低出生缺陷等挑战。这项研究证明,单细胞 RNA -seq技术能用于转录组定量分析,找到基因印迹等在基因调节区域上的遗传和/或表观遗传学改变所导致的表达缺陷,特别是该研究中发现的人类胚胎早期发育各阶段的关键候选基因将为改善人类辅助生殖技术和提高人口出生质量提供帮助。
本研究得到科技部973项目、科技部国际合作项目、国家自然科学基金委的基金资助。
作者简介:
刘嘉茵
女,妇产科学教授/主任医师,博士生导师,临床生殖医学中心主任。曾在美国做访问学者2年。1998年参与组建了江苏省生殖医学重点实验室,并建立了临床生殖医学中心。先后诞生了多项江苏省首例“试管婴儿”技术。主持的生殖医学中心首批通过了卫生部的审批。在临床上主持了多项新技术的开展。组创了省生殖健康和不孕症规范和质量控制的数据库系统。在基础研究方面,构建了多囊卵巢综合征的基因和蛋白谱系;研究排卵障碍的发病机理;探索子宫内膜异位症的发病机制和新型的生物学治疗途径;调查排卵障碍发病的环境因素等。主持了多项省部和国家级科研课题。两次获得省科技进步二等奖,和新技术引进奖多项。先后被评为省卫生厅重点医学人才和医学重点学科。参与了生殖医学博士学位授予点、部省共建重点实验室、国家重点实验室培育基地的建设。近年来在国内外杂志上发表了60余篇论文,SCI收录7篇。目前担任中华医学会计划生育学会常务委员、生殖医学学会委员、妇产科学会内分泌学组副组长等学术团体职务。
范国平
教授, 1995获美国凯斯西储大学神经科学的博士学位, 1994-2011年初在麻省理工学院Whitehead Institute 做博士后;2001至今任美国加州大学洛杉矶分校医学院人类遗传学系的终身制助理教授、副教授、正教授。在2009年起任同济大学讲座教授。他2007年起任美国国立卫生研究院研究基金特约评审员,美国马里兰州及康奈迪克州干细胞研究基金评审员,中国国家自然科学基金委员会及教育部长江学者海外特约评审员,及Science, Cell Stem Cell, PNAS、Neuron, Nature Neuroscience, Human Molecular Genetics, Stem Cells等多约20本国际杂志的审稿人.
范国平博士领导的团队发表了70多篇国际重要学术期刊的论著,在干细胞分化, 胚胎与神经发育的分子细胞机制研究等方面取得了显著成绩。特别是在DNA甲基化与组蛋白修饰等表观遗传学机制、干细胞基因表达、干细胞分化与神经细胞可塑性调控的研究中,做出了重要贡献。他的实验室构建出的中枢神经系统不同部位DNA甲基化缺陷的转基因小鼠,为研究行为异常等神经症状以及研究DNA甲基化与染色质重塑对大脑发育运行的影响提供了良好的模型系统。近年在眼科干细胞转化研究和临床治疗有新的突破。
原文检索:
Zhigang Xue, Kevin Huang, Chaochao Cai, Lingbo Cai, Chun-yan Jiang, Yun Feng, Zhenshan Liu, Qiao Zeng, Liming Cheng, Yi E. Sun, Jia-yin Liu, Steve Horvath& Guoping Fan. Genetic programs in human and mouse early embryos revealed by single-cell RNA sequencing. Nature, 28 July 2013; doi:10.1038/nature12364

