4月15日,南京医科大学生殖医学国家重点实验室、病原生物学系季旻珺教授团队(第一完成单位)与上海市精神卫生中心—中国科学院上海药物所联合实验室周子凯研究员团队合作在神经科学顶级期刊Nature Neuroscience《自然-神经科学》上发表了研究论文Rescue of maternal immune activation-induced behavioral abnormalities in adult mouse offspring by pathogen-activated maternal Treg cells(病原体激活的母源Treg细胞缓解母体免疫激活诱导的子代小鼠行为异常)。该研究建立了MIA的新型疾病动物模型,揭示了MIA影响子代免疫系统并造成孤独症相关表型的机制,并发现可以通过调节成年期子代小鼠的免疫系统改善其孤独症表型。

孤独症谱系障碍是一组中枢神经系统发育疾病,其致病机制复杂,病因高度异质化,存在巨大的未满足临床需求。目前学界主要聚焦于其遗传学病因及病理机制,已发现一部分孤独症的发生可归因于数百种遗传异常,因而缺乏具有普适性的靶点以支撑常规药物研发。流行病学及实验动物研究结果表明,孕期母体感染病原体所引发的母体免疫激活(MIA)是诱发子代产生孤独症等神经精神疾病的重要风险因素;同时,MIA对子代的外周和神经免疫系统可产生持久性影响,这可能是导致部分免疫异常型孤独症的原因。
研究者们首先采用感染全球1/3人口的弓形虫速殖子可溶性抗原(STAg)诱导MIA,建立子代具有免疫异常及孤独症表型的小鼠模型。与学界常用的病毒模拟物poly(I:C)及细菌模拟物LPS这两种化学物质相比,寄生虫模拟物STAg为复合抗原,可以更全面地诱导免疫谱系异常,特别是可以有效诱发获得性细胞免疫反应。结果发现:子代病鼠直至成年都存在外周及神经免疫谱系异常,其CD4+ T细胞谱与部分孤独症患者高度一致;并且病鼠具有社交互动缺陷、重复刻板动作、交流障碍的孤独症核心症状,以及显著的焦虑表型。
对成年病鼠进行过继性调节性T细胞(Treg)治疗(Adoptive Treg cell transfer therapy)后,研究者发现虽然病鼠脑白质纤维微结构异常的改善相对有限,但该治疗有效地逆转了绝大部分行为学表型。此外,通过单细胞测序技术(scRNA-seq)对比不同来源的Treg细胞的转录组,研究者们鉴定出一组高疗效的Treg细胞亚群及其转录组学特征,这类高疗效的Treg细胞能够更好地迁入与疾病症状关联的脑区起效。
该工作通过构建具有孤独症表型的新型MIA疾病动物模型并进行研究,提出采用依照上述高疗效Treg细胞亚群的分子特征进行工程化改造的调节性T细胞药物有望改善免疫异常型孤独症的核心症状,为后续临床转化研究提供了新思路。
南京医科大学副教授徐志鹏、中科院上海药物所博士后张小云、南京医科大学博士生常浩为并列第一作者。南京医科大学季旻珺教授与上海市精神卫生中心—中科院上海药物所周子凯研究员为共同通讯作者。该课题实施过程中获得国家自然科学基金面上、上海市科学技术委员会、江苏省自然科学基金、江苏省现代病原生物学重点实验室开放课题等项目的资助支持。
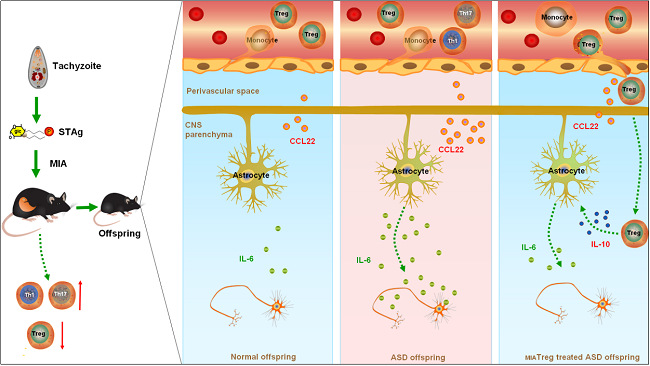
图示摘要:具有免疫异常型孤独症表型的MIA疾病模型及过继性Treg细胞治疗的起效机制。
原文链接:https://www.nature.com/articles/s41593-021-00837-1
(图文/季旻珺教授课题组;审核/科技处)

