3月2日,我校基础医学院刘文涛教授和药学院辛洪亮教授课题组合作在柳叶刀旗下的《电子生物医学》(EBioMedicine)杂志在线发表题为《中性粒细胞胞外诱捕网可作为治疗化疗诱发的外周神经病变的独特靶标》(Neutrophil Extracellular Traps as a Unique Target in the Treatment of Chemotherapy-Induced Peripheral Neuropathy)的研究论文。
该研究首次报道了中性粒细胞胞外诱捕网(NETs)介导的微循环障碍是化疗引起的周围神经病变(CIPN)的核心病理机制,并制备了一种缺血归巢肽(SHp,CLEVSRKNC)修饰的DNase1,实现了对于NETs的靶向降解,并可显著抑制化疗痛,为肿瘤治疗过程中的神经毒性预防提供了新方法。

化疗引起的周围神经病变是临床常见的化疗药剂量限制性毒副反应,在临床治疗上仍是一个巨大的挑战。目前尚未有任何药物可以有效防治,深入研究其发病机制及防治策略具有重大科研价值与社会意义。
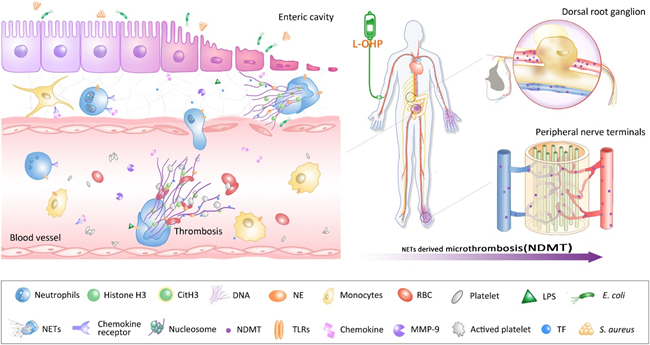
研究人员发现奥沙利铂可以导致小鼠出现化疗痛,在化疗过程中,血液中的中性粒细胞胞外诱捕网(NETs)持续性升高并累积到外周神经附近,NETs捕获组织因子诱导血栓形成,引起坐骨神经和背根神经节微循环紊乱和组织缺氧,通过诱发HIF-1α介导的MMP-9表达导致疼痛。NETs在血中升高的现象在临床病人身上也同样出现。因为NETs的特殊性质,属于血管内的死细胞堆积,使用传统的抗凝药(水蛭素)效果不佳,无法缓解CIPN进程中微循环问题和痛觉超敏。
为了克服以上问题,研究人员设计了一种缺氧导向的DNA酶递送策略,构建了缺血归巢肽(SHp)和Cy5荧光双修饰的DNase1的纳米药物,即Cy5-SHp-DNase1,该药物可以静脉注射,一方面作为活体缺氧探针显示缺氧部位,另一方面可靶向富集到NETs聚集的缺氧部位,实现对于NETs的在体高效降解,通过改善微循环障碍有效预防化疗痛。
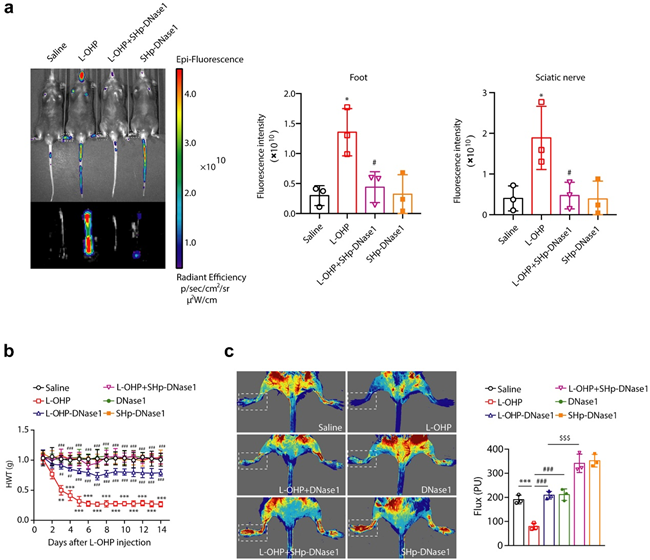
本研究揭示了化疗导致NETs产生引起微循环障碍是CIPN的核心病理机制,同时发现了SHp-DNase1靶向降解NETs可以有效缓解CIPN,为化疗痛提供了新的治疗策略与药物靶点。
该制剂已经申请了相关专利,具有良好的临床转化前景。
我校基础医学院博士研究生王超钰、林彤彤和胡亮副教授为本文的并列第一作者,基础医学院药理学系姜春懿副教授,药学院药学系辛洪亮教授,基础医学院药理学系刘文涛教授为共同通讯作者。
该工作得到国家自然科学基金、江苏省自然科学基金、南京医科大学“科技创新基金”重大专项、江苏省重点研发计划(社会发展)、南京市卫生科技发展专项等项目的资助。
原文链接: https://www.sciencedirect.com/science/article/pii/S2352396423000646?via%3Dihub
(素材来源/刘文涛教授和辛洪亮教授课题组)

