日前,我校的胡本慧团队与新加坡南洋理工大学陈晓东团队等合作,提出了一种超收缩聚合物主动包裹组织,快速原位形成生物接口的策略。该研究成果以《用于生物电子界面的水响应性超收缩聚合物膜》(Water-responsive supercontractile polymer films for bioelectronic interfaces)为题发表在《自然》(Nature)期刊上。

主动健康和重疾管理的需求使生物电子受到临床工作者的广泛关注,生物电子的可植入化和低功耗化弥补了众多影像设备无法长程在体采集信号的短板。然而,体内器官组织不仅尺寸形貌各异,心脏等器官还时刻处于周期性搏动中,导致电子设备与生物组织的接口无法标准化。仅依赖增强器件与组织的界面黏附能可能导致黏附损伤和增加手术复杂度,且在不规则组织表面仍难以形成稳定的共形贴附。
针对上述问题,来自该研究突破了现有生物材料的局限,发展了一种新的驱动薄膜迅速收缩的方式:水分子驱动。不同于聚焦超声、热、光等驱动方式,水驱动不仅生物安全,且可以充分利用体内组织液原位快速形成稳固生物接口。并且接口在收缩成型后依然保持与体内组织相近的低模量(~100 kPa)和高可拉伸率(~600%),显著简化了手术植入操作,因此可以在内窥镜下通过微创手术完成植入。
这种超收缩聚合物(WRAP)由聚乙二醇-α环糊精包合物结晶域与水溶性半结晶聚环氧乙烷域交联组成,通过冷拔工艺使半晶域聚环氧乙烷分子取向,该取向显著提升了聚合物膜遇水后的收缩率,而半结晶域的破坏是实现“收缩变软”的关键,薄膜收缩后杨氏模量可下降三个数量级以上。此外,整体聚合物分子呈现的微观多孔结构亦赋予了薄膜可集成导电层的能力,且集成工艺兼容图案化工艺,确保了电子器件的高导电率和应变耐受性。
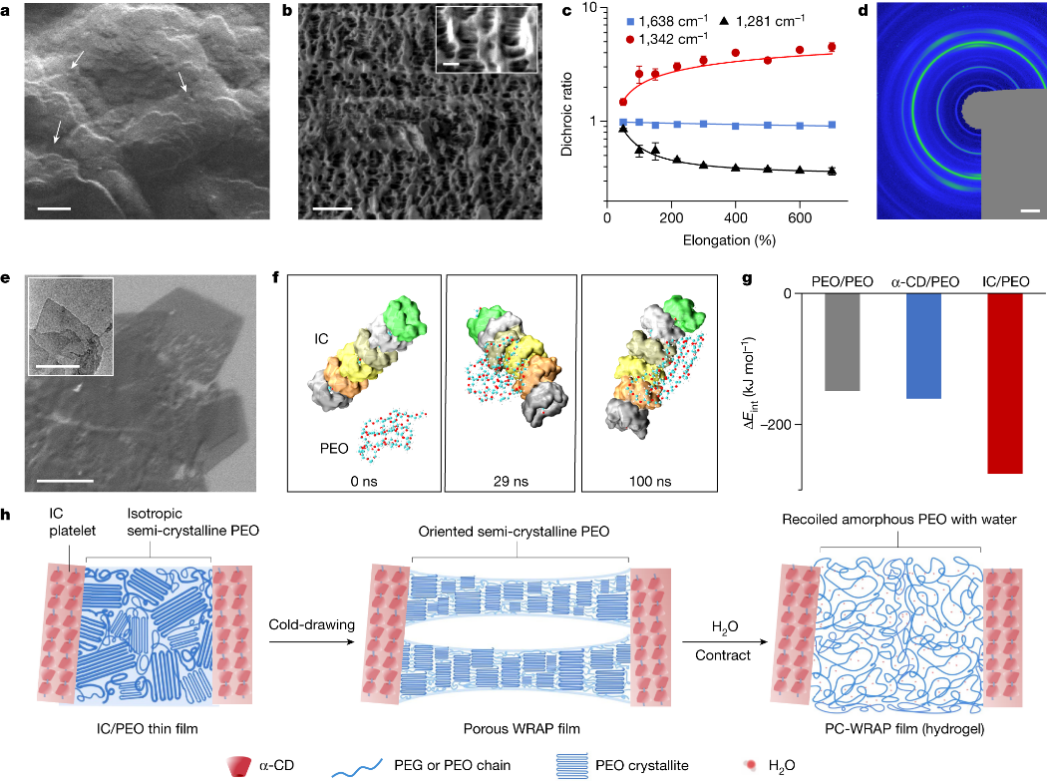
WRAP薄膜的微观结构及超收缩机理
活体动物实验证明,由该超收缩薄膜制备的自适应生物电子,可以在形状各异的湿润组织表面形成长程鲁棒的生物接口。值得指出的是,即便在连续搏动的心脏表面,仅通过微创胸腔镜手术就可以原位快速完成植入,并实现器件对心外膜的无缝包裹。整个植入手术可在十分钟内完成,且无需做心脏停跳处理。植入后器件在正常搏动和快速性心律失常的心脏表面均能够稳定地监测到高质量的心外膜电信号。
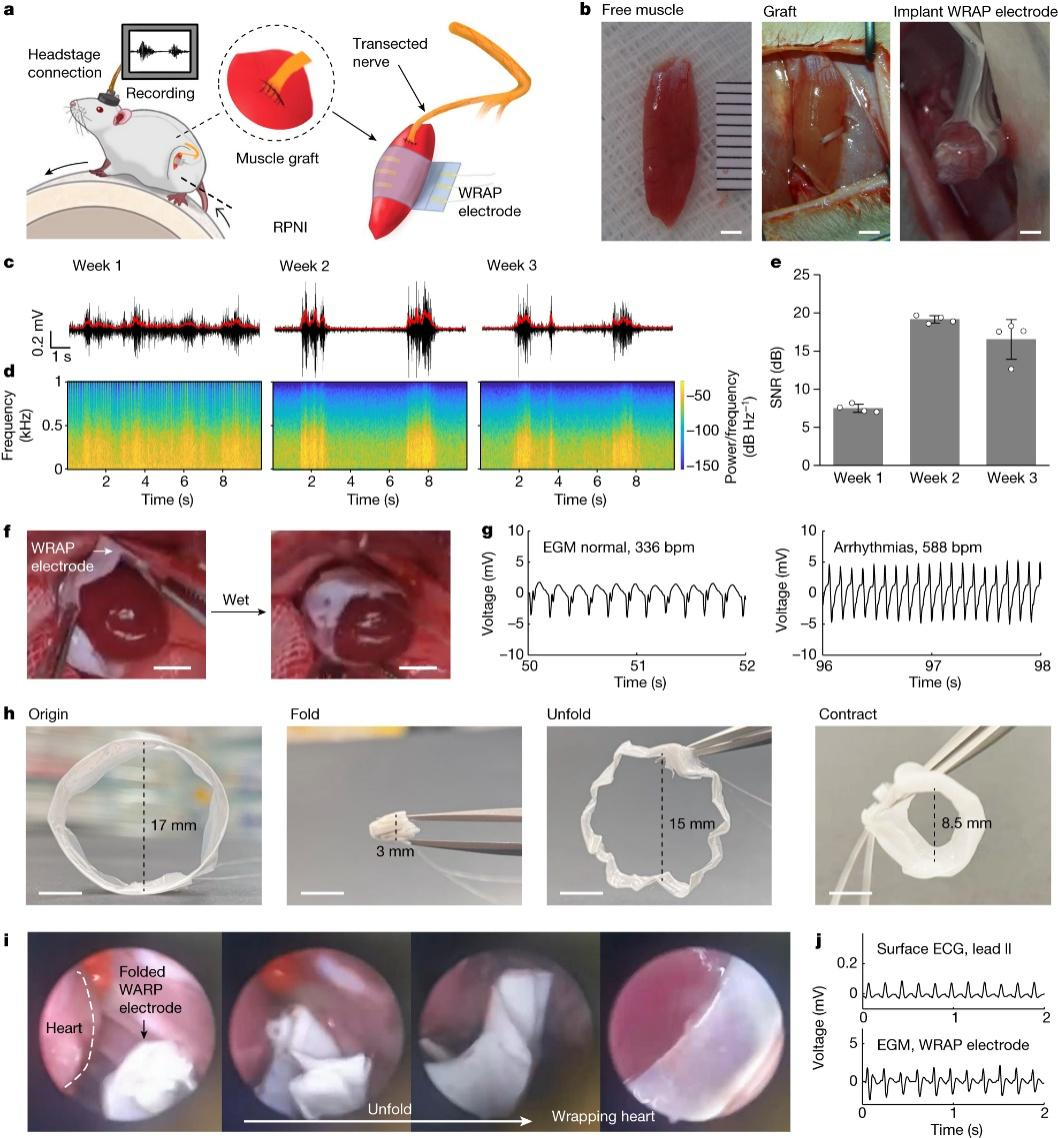
WRAP电极用于再生周围神经界面、心外膜记录和微创植入
Yi, J., Zou, G., Huang, J. et al. Water-responsive supercontractile polymer films for bioelectronic interfaces. Nature 624, 295–302 (2023).
原文链接:https://doi.org/10.1038/s41586-023-06732-y
(素材来源/胡本慧团队 审核/张慎忠)

