近期,我校基础医学院汪秀星教授与卫健委抗体技术重点实验室张茜、匹兹堡大学医学中心Jeremy Rich和美国克利夫兰癌症中心杨凯林合作在《细胞死亡和分化》(Cell Death & Differentiation)期刊在线发表了题为《IFI35调节非经典NF-κB信号来维持胶质瘤干细胞并招募肿瘤相关巨噬细胞》(IFI35 regulates non-canonical NF-κB signaling to maintain glioblastoma stem cells and recruit tumor-associated macrophages)的研究论文。该研究揭示了IFI35通过非经典型NF-κB信号维持胶质瘤干细胞与肿瘤相关巨噬细胞免疫抑制微环境的调控新机制,靶向双重调控干细胞和微环境的转录调节因子IFI35可有效抑制胶质瘤的恶性进展与肿瘤形成,为胶质瘤的临床诊治新策略提供重要的科学依据。

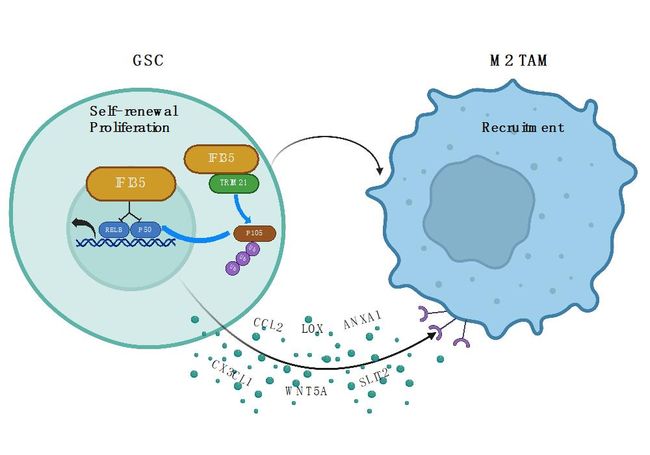
该工作通过筛选胶质母细胞瘤(GBM)发生发展过程中调控胶质瘤干细胞(GSCs)与微环境肿瘤相关巨噬细胞(TAMs)的关键转录调节因子,并通过生物学功能验证IFI35在促进GSCs与免疫抑制微环境中发挥重要作用。机制上,IFI35通过E3泛素连接酶TRIM21调控NFKB1由前体p105向p50不完全降解的过程,并活化GSCs中的NF-κB信号通路促进GSCs增殖与自我更新。另一方面,IFI35以非经典型NF-κB信号RELB/p50转录复合体结合的方式调控GSCs下游趋化因子CCL2、LOX、ANXA1、CX3CL1等表达分泌,进而影响微环境中免疫抑制型TAMs招募。因此,GSCs高表达的IFI35能够直接或间接调控GSCs与微环境中TAMs,从而促进免疫抑制微环境形成,并最终介导肿瘤免疫逃避与GBM恶性进展。
该研究揭示了IFI35作为双重调控GSCs与微环境TAMs亚群的关键分子,通过调控NFKB1不完全降解,并与非经典型RELB/p50转录复合体结合的方式调控GSCs及其免疫抑制微环境,靶向IFI35及下游信号,为改善GBM临床治疗提供有效新靶点。
我校基础医学院博士生李大奇、第一附属医院神经外科王协峰、基础医学院硕士生陈可欣、公共卫生学院博士生单丹阳、基础医学院硕士生崔高源为本文共同第一作者,我校汪秀星教授、卫健委抗体技术重点实验室张茜、匹兹堡大学医学中心Jeremy Rich和美国克利夫兰癌症中心杨凯林为共同通讯作者。课题还获得了我校第一附属医院神经外科尤永平主任、南京医科大学生殖国家重点实验室李朝军教授等多位合作者的指导和支持。该研究获得国家重点研发计划、国家自然科学基金等项目资助。
原文链接:https://www.nature.com/articles/s41418-024-01292-8
(供稿/汪秀星课题组;审核/陈峰 王觉进)

