近日,我校药学院胡琴教授和岑瑶副教授研究团队在国际知名学术期刊《核酸研究》(Nucleic Acids Research)发表了题为《FRAME:flap核酸内切酶1工程化PAM模块以精准、灵敏调控CRISPR/Cas12a的反式切割活性》(FRAME: flap endonuclease 1-engineered PAM module for precise and sensitive modulation of CRISPR/Cas12a trans-cleavage activity)的研究论文。

来源于细菌和古细菌的CRISPR系统(The clustered regularly interspaced short palindromic repeats, CRISPR)可以提供原核适应性免疫防御系统来降解入侵的核酸,目前已成为基因编辑、转录调控和分子诊断的革命性工具。其中,CRISPR/Cas12a系统以其精确的识别和高效的核酸切割能力而闻名,在分子诊断和生物传感领域表现出卓越的性能。以往的研究主要集中在工程CRISPR RNA(crRNA)或Cas12a蛋白来调节Cas12a系统的功能,使用的策略包括光笼化、可逆乙酰化、二聚化、环化crRNA和扩展crRNA等。然而,这些方法复杂、耗时且仅在特定条件下有效,限制了它们的应用。相反,工程化DNA链是一个更简单、更经济的选择,允许直接设计和精确编程Cas12a的反式切割活性,从而增强其生物识别和信号转导输出能力。
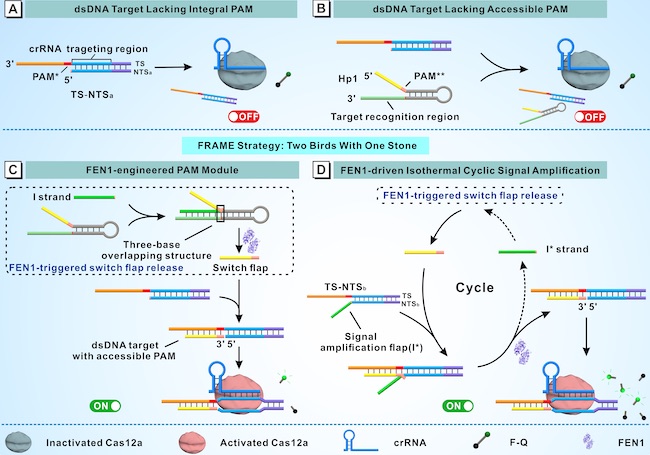
本研究报道了一种新的CRISPR/Cas12a系统反式切割活性工程化策略,利用Flap核酸内切酶1(Flap endonuclease 1, FEN1)来调节Cas12a双链DNA激活子中原间隔子邻近基序(Protospacer adjacent motif, PAM)模块的可及性(Flap endonuclease 1 to regulate the accessibility of the protospacer adjacent motif module in the double-stranded DNA activator, FRAME),即FRAME策略,继而精准调控Cas12a的反式切割活性。具体来说,FEN1通过识别靶输入与底物之间形成的三碱基重叠结构,从而选择性地切割并释放含有“TTTN”序列的5'-flap。该双功能flap在形成缺口PAM的同时,还触发了FEN1的二次裂解,最终实现Cas12a反式切割活性的敏感切换。FRAME策略体现了“一石二鸟”的效果,因为它不仅通过调节PAM模块的可及性精确地编程了Cas12a的活性,而且同时触发了等温循环扩增。此外,研究进一步展示了该策略在检测各种靶标中的应用,如髓过氧化物酶和miR-155,从而开发了一个敏感、特异的生物传感平台。值得注意的是,整个反应过程在37℃下进行,无需重复退火、高温条件或磁分离辅助步骤,而这些通常用于已报道的涉及FEN1的扩增反应。总的来说,FRAME策略具有显著的简单性、温和性和敏感性,为工程化Cas12a的反式切割活性引入了一个创新的概念,在医学诊断方面显示出卓越的潜力。
药学院胡琴教授、岑瑶副教授和香港中文大学(深圳)唐本忠教授、赵征教授为该论文的共同通讯作者。药学院2022级硕士研究生左铜山为该论文的第一作者。该研究得到了国家自然科学基金和江苏省青蓝工程基金项目等资助。
原文链接:https://doi.org/10.1093/nar/gkae804
(撰稿/胡琴课题组;审核/刘明捷 陈宏山)

