近日,基础医学院药理学系、神经退行性疾病省重点实验室胡刚教授课题组在《科学进展》(Science Advances)在线发表了题为《β-arrestins通过Samd4/mTOR/OXPHOS轴差异对抗的调控帕金森模型中IL-4诱导的小胶质细胞》(Antagonism of β-arrestins in IL-4–driven microglia reactivity via the Samd4/mTOR/OXPHOS axis in Parkinson’s disease)的研究论文,揭示了IL-4诱导的小胶质细胞对PD的保护作用,并且阐明了G蛋白偶联受体下游的非经典信号β-arrestin1和2在其中的拮抗作用和分子机制,为靶向小胶质细胞的PD治疗药物的开发提供新方向。

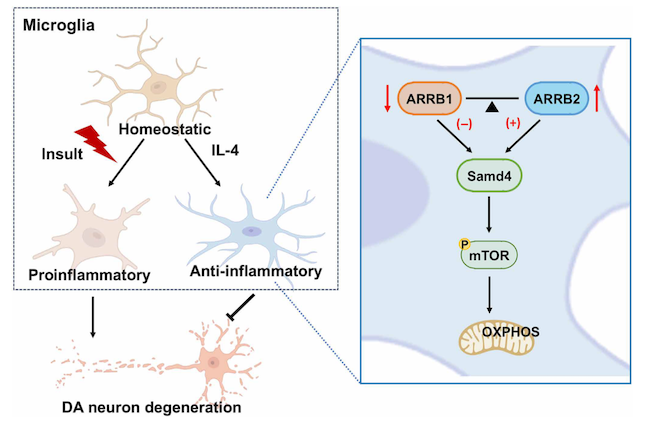
帕金森病(Parkinson’s disease , PD)是第二大最常见的神经退行性疾病,神经炎症和黑质致密部(Substantia nigra pars compacta , SNc)中多巴胺能(Dopaminergic , DA)神经元的变性是帕金森病的病理特征。小胶质细胞是大脑驻留的免疫细胞,在中枢神经系统(Central nervous system , CNS)的稳态中发挥重要作用,也是与PD发病机制密切相关的细胞类型之一。然而,控制小胶质细胞激活的一般免疫抑制药物的治疗作用是有限的,特别是在临床实验中。究其原因,除了神经毒性作用外,小胶质细胞也对维持神经元的功能和活性有着积极作用。白细胞介素4(Interleukin-4 , IL-4)是一种多功能的细胞因子,也在大脑中表达,并调节中枢神经系统的生理功能。大量研究表明,IL-4诱导抗炎型和神经营养状态的小胶质细胞,在中枢神经系统疾病的模型中产生神经保护和神经再生的作用,然而,IL-4诱导的小胶质细胞在帕金森病中是否具有保护作用以及调控机制仍不明确。β-arrestins(ARRBs)为调节G蛋白偶联受体(GPCRs)内化和转运的下游非经典信号,分为两种亚型β-arrestin1(ARRB1)和β-arrestin2(ARRB2)。尽管这两个蛋白的同源性很高且在结构上密切相关,但它们可调节不同甚至相反的功能作用。前期课题组研究也发现ARRB1和ARRB2通过调控小胶质细胞的炎症反应差异性的影响PD的发生和发展。
本研究阐明了IL-4通过诱导抗炎型小胶质细胞活化发挥治疗PD的作用,能够减轻了PD样运动障碍和DA神经元的丢失,阐明如何发挥小胶质细胞的有益作用具有重要的意义,是PD治疗的新方向。同时,此研究发现在IL-4诱导小胶质细胞上ARRB1和ARRB2的表达分别减少和增加,并揭示了ARRB1和ARRB2在IL-4诱导的抗炎型小胶质细胞及其对PD的神经保护作用起着重要且相反的调控作用,两者通过下游效应器Samd4调节mTOR通路的激活情况,进而影响小胶质细胞线粒体的氧化磷酸化功能,从而对IL-4诱导的小胶质细胞的激活发挥拮抗且平衡的调控作用。结合课题组之前的研究结果共同表明靶向小胶质细胞ARRBs介导的功能拮抗平衡可能是开发PD治疗药物的潜在方向。ARRBs作为多功能脚手架蛋白,能通过与各类蛋白结合发挥重要的生理和病理作用,因此,后续进一步研究ARRBs调节Samd4等下游蛋白表达的作用模式,将进一步帮助特异性治疗药物靶点的研发。
该研究由基础医学院药理学系胡刚教授课题组完成,胡刚教授、方吟荃副教授为共同通讯作者。基础医学院博士研究生刘嘉琪为第一作者,博士研究生梁越也参与了本研究的完成。本课题得到科技创新2030-“脑科学与类脑研究”重大项目、国家自然基金重点项目等支持。胡刚教授课题组长期从事神经精神药理学研究,在帕金森病、抑郁症、脑卒中等重大疾病的发生机制和药理学研究领域形成了鲜明的特色和优势。在国际高影响力期刊Nature、Nat Neurosci、Nat Commun等发表SCI论文200余篇。研究成果获国家技术发明奖二等奖1项、省部级科技进步奖或科学技术奖一等奖3项、教育部自然科学奖二等奖1项。
原文链接:https://www.science.org/doi/10.1126/sciadv.adn4845
(供稿/胡刚课题组;审核/陈峰 王觉进)

