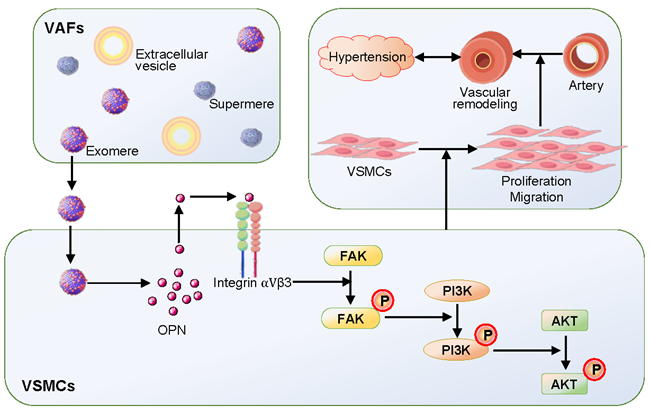
近日,基础医学院生理学系心血管实验室朱国庆教授团队在《细胞外囊泡杂志》(Journal of Extracellular Vesicles)发表了题为《自发性高血压大鼠外膜成纤维细胞来源的外泌颗粒通过转运骨桥蛋白促进血管重构》(Exomeres from adventitial fibroblasts of spontaneously hypertensive rats promote vascular remodelling via transferring osteopontin)的研究论文,发现自发性高血压大鼠的血管外膜成纤维细胞释放外泌颗粒(exomeres,EMs),通过转运骨桥蛋白激活整合素αVβ3/FAK/PI3K/AKT信号通路,促进血管平滑肌细胞增殖和迁移,促进血管重构和加重高血压,表明自发性高血压大鼠的血管外膜成纤维细胞释放的EMs在高血压和血管重构中起重要作用,干预血管的骨桥蛋白和EMs可能是减轻高血压血管重构的潜在治疗策略。

EMs和超微颗粒(supermeres,SMs)是近年来新发现的2种具有重要的细胞间通讯功能的非囊泡性细胞外纳米颗粒(NVEPs),EMs和SMs不同于细胞外囊泡(extracellular vesicles,EVs),没有脂质双分子层膜包裹,且颗粒直径更小。NVEPs的心血管病理生理学作用和机制尚不明确。本研究在前期探讨EVs在高血压血管重构中的作用与机制的基础上,首次从血管外膜成纤维细胞中分离出EMs和SMs,并对EVs、EMs和SMs的特征进行比较和鉴定,发现自发性高血压大鼠血管外膜成纤维细胞释放的EMs在血管平滑肌细胞增殖和迁移、血管重构和高血压发病机制中起重要作用,并揭示了其通过转运骨桥蛋白激活下游整合素αVβ3/FAK/PI3K/AKT信号通路的重要机制,发现敲降动脉的骨桥蛋白减轻高血压动物对应部位的血管重构,而长期静脉注射SHR的EMs可加重血管重构和高血压,EMs和骨桥蛋白是干预高血压血管重构的重要靶点,该研究为防治高血压血管重构提供了新的理论依据、实验基础和策略。
我校基础医学院生理学系朱国庆教授和熊晓青副教授为本论文共同通讯作者,王静晓博士为本论文第一作者。本研究得到国家自然科学基金、江苏省研究生科研与实践创新计划、江苏省心血管病转化医学协同创新中心等资助。
原文链接:
https://isevjournals.onlinelibrary.wiley.com/doi/10.1002/jev2.70146
(供稿/朱国庆课题组;审核/陈峰 王觉进)

